Алкеновые вуглеводні (олефіни) є одним із класів органічних речовин, яким притаманні свої хімічні і фізичні властивості. Види ізомерії алкенів у представників даного класу не повторюються з ізомерією інших органічних речовин.
Характерні ознаки класу
Етиленові олефинами іменують один з класів неграничних вуглеводнів, що містять один подвійний зв’язок.
По фізичним властивостям представники даної категорії неграничних з’єднань є:
- газами,
- рідинами,
- твердими сполуками.
 У складі молекул присутня не тільки «сигма»-зв’язок, але і «пі»-зв’язок. Причиною цього є наявність в структурній формулі гібридизації «sp2», якій властиво розташування атомів з’єднання в одній площині.
У складі молекул присутня не тільки «сигма»-зв’язок, але і «пі»-зв’язок. Причиною цього є наявність в структурній формулі гібридизації «sp2», якій властиво розташування атомів з’єднання в одній площині.
При цьому між ними формується кут не менше ста двадцяти градусів. Негибридизованным орбиталям «р» властиво розташування як поверх молекулярної площині, так і під нею.
Така особливість будови призводить до формування додаткових зв’язків – «пі» або «π».
Описана зв’язок менш міцний порівняно з «сигма»-зв’язками, так як перекриття боком має слабке зчеплення. Для сумарного розподілу електронних густин утворюються зв’язків характерна неоднорідність. При обертанні біля вуглець-вуглецевого зв’язку відбувається порушення перекривання «р»-орбіталей. Для кожного алкена (олефін) така закономірність є характерною ознакою.
Практично всім этиленовым з’єднанням притаманні високі температури кипіння і плавлення, характерні не для всіх органічних речовин. Представники зазначеного класу ненасичених вуглеводів швидко розчиняються у воді і інших розчинниках органічного складу.
Увага! Ациклічні ненасичені сполуки етиленові вуглеводні мають загальну формулу — c n h 2n.
Гомологія
Виходячи з того, що загальна формула алкенів c n h 2n, їм властива певна гомологія. Гомологічний ряд алкенів починає перший представник етилен або этен. Дана речовина в звичайних умовах є газом і містить два атоми вуглецю і чотири атома водню – C2H4. За этеном гомологічний ряд алкенів продовжує пропен і бутен. Їх формули такі: «C3H6» і «C4H8». При звичайних умовах є газами, які важче повітря, а значить, збирати їх необхідно пробіркою, перевернутої вниз дном.
 Загальна формула алкенів дозволяє розрахувати наступного представника цього класу, що має не менше п’яти атомів вуглецю у структурній ланцюга. Це пентен з формулою «C5H10».
Загальна формула алкенів дозволяє розрахувати наступного представника цього класу, що має не менше п’яти атомів вуглецю у структурній ланцюга. Це пентен з формулою «C5H10».
По фізичних характеристиках зазначена речовина відноситься до рідин, так само як дванадцять таких сполук гомологічної лінії.
Серед алкенів із зазначеними характеристиками є і тверді речовини, які починаються з формули C18H36. Рідким і твердим этиленовым вуглеводнів не властиве розчинення у воді, але при попаданні в органічні розчинники вони вступають з ними в реакцію.
Описана загальна формула алкенів передбачає заміну раніше стояв суфікса «ан» на «єп». Це закріплено правилами ІЮПАК. Будь-представника даної категорії з’єднань ми не взяли, у них всіх є описаний суфікс.
У назві етиленових з’єднань завжди присутня певна цифра, яка вказує на місце розташування подвійного зв’язку у формулі. Прикладами цього є: «бутен-1» або «пентен-2». Атомну нумерацію починають з того краю, до якого ближче знаходиться подвійна конфігурація. Це правило є «залізним» у всіх випадках.
Ізомерія
В залежності від наявного виду гібридизації алкенів їм притаманні деякі типи ізомерії, кожен з яких має свої особливості та будову. Розглянемо основні види ізомерії алкенів.
Структурного типу
Структурна ізомерія поділяється на ізомери:
- вуглецевого скелету;
- розташування подвійного зв’язку.
Структурні ізомери вуглецевого скелета виникають у разі появи радикалів (відгалужень від головної ланцюга).
Ізомерами алкенів зазначеної ізомерії будуть:
Бутен-1:
CH2=CH—CH2—CH3.
2-метилпропен-1:
CH2=C—CH3
│
CH3.
У представлених сполук загальна кількість вуглецевих і водневих атомів (C4H8), але різну будову вуглеводневого скелету. Це структурні ізомери, хоча властивості їх не однакові. Бутену-1 (бутилену) притаманний характерний запах і наркотичні властивості, що подразнюють дихальні шляхи. Цими особливостями не володіє 2-метилпропен-1.
В даному випадку немає ізомерів у етилену (C2H4), оскільки він складається тільки з двох вуглецевих атомів, куди можна підставити радикали.
Рада! Радикал дозволяється ставити до середнім і передостаннім вуглецевим атомів, але не дозволяється розташовувати їх близько крайніх заступників. Це правило працює для всіх неграничних вуглеводнів.
Щодо розташування подвійного зв’язку розрізняють ізомери:
Пентен-1:
CH2=CH—CH2—CH2-CH3.
Пентен-2:
CH3-СН=CH—CH2-CH3.
Загальна формула алкенів у представлених прикладів: C5H10,, але місце розташування однієї подвійний зв’язку різне. Властивості зазначених сполук будуть відрізнятися. Це структурна ізомерія.

Ізомерія
Просторового типу
Просторова ізомерія алкенів пов’язана з характером розташування вуглеводневих заступників.
На підставі цього розрізняють ізомери:
- «Ціс»;
- «Транс».
Загальна формула алкенів дозволяє створювати «транс-ізомери» і «цис-ізомери» у одного і того ж з’єднання. Візьмемо, приміром, бутилен (бутен). Для нього можна створити ізомери просторової будови, по-різному розташувавши щодо подвійного зв’язку заступників. З прикладами ізомерія алкенів буде виглядати так:
«цис-ізомер» «транс-ізомер»
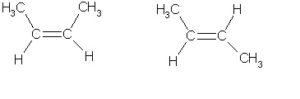
Бутен-2 Бутен-2
Із зазначеного прикладу видно, що у «цис-ізомерів» по одну сторону площині розташування подвійного зв’язку знаходяться два однакових радикала. Для «транс-ізомерів» це правило не працює, так як у них щодо вуглецевого ланцюга «З=» розташовуються два не схожих заступника. Враховуючи цю закономірність, можна самим будувати «ціс» і «транс ізомери для різних ациклічних етиленових вуглеводнів.
Представлені «цис-ізомер» і «транс-ізомер» для бутена-2 неможливо перетворити один в інший, так як для цього необхідно обертання навколо наявної вуглецевої подвійний ланцюжка (С=С). Щоб здійснити дану обертання необхідно певну кількість енергії, щоб розірвати існуючу «p-зв’язок».
На підставі усього вищевикладеного можна зробити висновок, що ізомери «транс» і «ціс» виду є індивідуальними сполуками з певним набором хімічних і фізичних властивостей.
Немає ізомерів у будь алкена. Просторових ізомерів не має етилен з-за однакового розташування водневих заступників щодо подвійного ланцюга.
Міжкласові
Міжкласова ізомерія у алкеновых вуглеводнів поширена значно. Причиною цього є схожість загальної формули представників даного класу з формулою циклопарафинов (циклоалканов). У даних категорій речовин у формулах однакову кількість вуглецевих і водневих атомів, кратне складу (c n h 2n).
Міжкласові ізомери будуть виглядати так:
Пропен-1:
CH2=CH—CH3.
Циклопропан:
CH2
∕ \
CH2―CH2.
Виходить, що формулою C3H6 відповідають два з’єднання: пропен-1 і циклопропан. З структурної будови видно різне розташування вуглецю відносно один одного. За властивостями зазначені сполуки також різні. Пропен-1 (пропілен) – це газоподібне з’єднання з низькою температурою кипіння. Для циклопропана характерно газоподібний стан з різким запахом і їдким смаком. Хімічні властивості цих речовин також розрізняються, але склад у них ідентичний. В органічний хімії даний вид ізомерів іменують межклассовым.
Алкени. Ізомерія алкенів. ЄДІ. Органічна хімія.
Алкени: Будова, номенклатура, ізомерія
Висновок
Алкеновая ізомерія – це їхня найважливіша характеристика, завдяки якому в природі з’являються нові сполуки з іншими властивостями, які знаходять застосування в промисловості та побуті.
